News
| [바이오스펙테이터] 노벨티노빌리티 "c-KIT 新기전 AMD 치료제 도전" | |
|---|---|
|
Date : 2019.09.10
Link : http://www.biospectator.com/view/news_view.php?varAtcId=8437 |
|
|
http://www.biospectator.com/view/news_view.php?varAtcId=8437 탐방
노벨티노빌리티 "c-KIT 新기전 AMD 치료제 도전" 바이오스펙테이터 조정민 기자 VEGF
타깃의 기존 치료제와 작용기전 차별화.. “안질환
원천 특허 보유, 항암제까지 확장”
▲박상규 노벨티노빌리티 대표이사.
국내에
새로운 항체전문 치료제 개발 바이오텍이 모습을 드러냈다. 직접 발굴한 완전 인간 항체를 바탕으로 안질환
치료제 및 항암제 개발에 주력한다는 계획이다. 박상규
아주대 교수가 2017년 창업한 노벨티노빌리티는 기존의 VEGF(혈관내피성장인자)가 아닌 c-KIT을 타깃으로 황반변성 치료제 개발에 도전한다. 노벨티노빌리티는 조혈기능을 하는 것으로 알려졌던 c-KIT이 혈관투과성
증가와 신생혈관생성에 핵심인자라는 것을 최초로 입증하고 이를 토대로 치료제를 개발하기 위해 회사를 설립했다. 박상규
노벨티노빌리티 대표는 “현재 습성황반변성 치료제로 사용되는 VEGF 억제 기전의 약물들의 경우 약 20~40%의 환자들에게서 원하는 치료효과가 나타나지 않고 있다. 우리는 VEGF가 아닌 새로운 혈관생성인자 c-KIT을 규명했고 이를 타깃하는
치료제를 개발함으로써 VEGF 치료제에 효과를 보지 못한 환자들에게 새로운 치료 옵션을 제공할 것”이라고
말했다. 노벨티노빌리티는
지난 5월 메디톡스벤처투자를 통해 TIPS 과제에 선정됐으며
현재 시리즈A 투자를 진행하고 있다. ◇c-KIT의 신생혈관생성 기능 최초로 규명.. "c-KIT 타깃
안질환 치료제 관련 韓·美 원천적 권리 확보” 노벨티노빌리티가
타깃하는 c-KIT은 타이로신 키나아제 수용체의 일종으로 줄기세포 성장인자 수용체 또는 CD117이라고도 한다. C-KIT은 주로 조혈줄기세포(hematopoetic stem cell) 표면에서 발현되며 내피전구세포(endothelial
progenitor cell) 마커로도 잘 알려졌다. c-KIT에 줄기세포인자(stem cell factor;
SCF)가 결합하면 티로신 키나아제를 활성화시키는 이량체를 형성하고 이후 하위 신호기전을 활성화한다.
c-KIT은 세포의 생존과 증식, 분화를 유도하며 조혈기능을 가진 것으로 밝혀졌다.
▲SCF/c-KIT 신호체계 모식도 (노벨티노빌리티
제공) 노벨티노빌리티의
사외이사를 맡고 있는 서원희 중앙대 교수와 박상규 대표는 c-KIT이 기존에 알려져 있는 기능 외에
병리적인 상황에서의 신생혈관형성과 혈관투과성 증가에 관여한다는 것을 세계 최초로 밝혀냈다. 박
대표는 “저산소증(hypoxia) 상태가 되면 내피세포에서 c-KIT의
발현이 증가되고 SCF에 의한 내피세포의 신생혈관 생성이 늘어나게 된다. 이러한 병리적인 혈관형성은 습성황반변성, 당뇨성 망막병증 등 여러가지
안질환에서 실명이 일어나는 주요 원인”이라고 말했다. 박
대표와 서원희 교수외 연구진은 산소와 레이저로 망막병증을 유도한 동물모델에서 c-KIT과 SCF의 발현이 눈 조직에서 유의미하게 증가한 것을 확인했으며, c-KIT 억제제를
적용했을 때 병리적인 신생혈관생성이 억제된 것을 확인했다. 해당 연구결과는 지난달 22일, 국제 학술지 ‘Arteriosclerosis,
Thrombosis, and Vascular Biology’에 게재됐다. 박
대표는 “VEGF는 혈관의 정상적인 기능을 위해 꼭 필요한 인자다. 따라서 VEGF 억제제를 사용하면 그에 따른 부작용 위험이 생기게 된다. 하지만 c-KIT의 경우에는 질환 상황에서만 발현이 높아지기 때문에 정상적인 혈관 형성에는 영향을 미치지 않는다는 것이
타깃의 장점”이라고 설명했다. 또한
“VEGF와 다른 혈관생성유발인자인 SCF가 서로 독립적인
기전으로 작용하고 있기 때문에 SCF에 의해 유발된 신생혈관 형성에
VEGF 억제제가 영향을 주지 못한다. 이를 감안하면
VEGF 억제 기전의 기존 약물에 반응하지 않는 환자들의 경우, SCF에 의한 혈관생성일
가능성이 높아 c-KIT 저해제가 새로운 치료 옵션이 될 수 있다”고 덧붙였다. 저산소
상태가 되면 SCF와 c-KIT과 함께 HIF-1α(hypoxia inducible factor-1α)의 발현이 증가하게 되며 이 때 SCF는 HIF-1α를 안정화시켜 저산소증을 장기화하게 된다. 저산소 상태가
지속되면 다시 VEGF/VEGFR이 증가하는 악순환이 일어난다. 박
대표는 “c-KIT 저해제로 SCF 신호를 차단하면 HIF-1α를 해소해 혈관신생을 자극하는 요인을 제거할 수 있게 된다”고 말했다. c-KIT의 혈관신생기전을 최초로 밝혀낸 노벨티노빌리티는 ‘SCF/c-KIT 신호를 타깃하는 안질환 치료제 개발’과 관련된 원천 특허를 각각 미국과 한국에서 확보한 상태다. ◇“c-KIT 타깃 항체 치료제, 습성황반변성·당뇨병성망막병증 등 안질환 2차치료제로 개발” 노벨티노빌리티는 c-KIT 항체 치료제의 일차적인 타깃 적응증으로 습성황반변성, 당뇨병성
망막병증 등의 안질환을 선택했다. 황반변성은
망막에 산소와 영양 공급이 제대로 이뤄지지 않아 황반이 손상되는 질환으로 신생혈관 유무에 따라 건성황반변성과 습성황반변성으로 나눌 수 있다. 습성황반변성의 경우 비정상적인 신생혈관으로 인해 출혈이 일어날 가능성이 높아 심각한 시력저하, 시야 왜곡 등이 나타나고 증상이 빠르게 악화되는 것으로 알려졌다. 현재
황반변성의 치료제로 사용되는 약물은 아일리아(Eylea), 루센티스(Lucentis),
아바스틴(Avastin) 등이 있으며 모두 VEGF를
억제하는 기전의 치료제다. 하지만 VEGF 억제제를 적용한
이후에도 누수가 지속 또는 재발하며 효과를 보지 못하는 환자들이 존재한다. 박
대표는 “항-VEGF 치료를 6회 적용한 뒤에도 누수가 관찰되면
이를 난치성(refractory)으로 판단하게 된다. 전체
환자 중 20~40%가 이러한 난치성에 해당한다”며 “현재는 3가지
약물을 교차 처방하는데 그치는데 이를 뒷받침하는 임상적 근거도 존재하지 않는 상황”이라고 설명했다. 노벨티노빌리티는
바로 이 난치성 환자들을 타깃한 2차 치료제로 c-KIT 억제제를
개발한다는 전략이다. 회사 측은 “VEGF 치료제에 대한
의료진의 선호도와 곧 이어 발매될 바이오시밀러들과의 경쟁 등을 고려해 VEGF 치료에 반응하지 않는
환자들에게 적용할 2차 치료제로 개발하는 전략을 선택했다”고 밝혔다. 노벨티노빌리티는
스크리닝과 최적화를 거쳐 발굴한 항체 후보물질 ‘NN2101’에 대해 효능과 작용기전, 세포독성과 약물동태(PK), 면역원성 시험까지 완료한 상태다. 황반변성 동물모델을 이용해 ‘아일리아’와의 효능 비교 실험을 진행한 결과에서 동등성 이상의 약효를 확인했다. 또한 신생혈관생성을 촉진하는 저산소증과 신생혈관과 함께 관찰되는 병리적 현상인 무혈성 지역(avascular area) 역시 개선하는 결과를 얻었다. 박
대표는 “현재 비임상 시료 생산을 위해 세포주 개발을 진행하고 있으며 전임상 이후 2021년 임상에
진입하는 것을 목표로 한다”고 말했다. ◇c-KIT 변이 내성 항암제로도 개발.. “변이와 상관없이 수용체 자체를
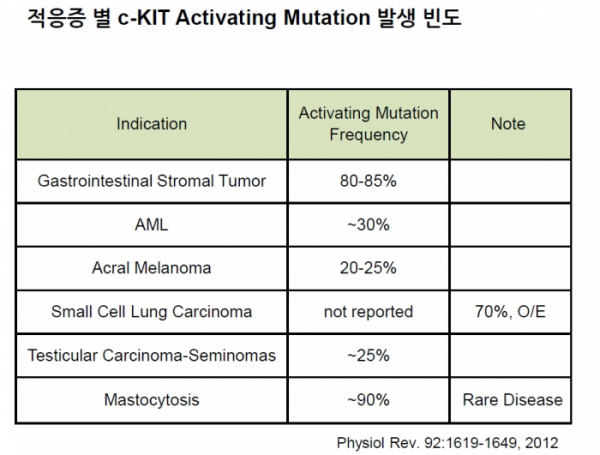
무력화하는 ADC 치료제 개발” 노벨티노빌리티는 c-KIT 억제제를 안질환 뿐만 아니라 다양한 암종에 적용할 수 있는 항암제로도 개발하고 있다. C-KIT은 종양 유전자 중 하나로 암의 전이나 항암제 저항성을 일으키는 주요 원인으로 연구되고 있으며 위장관기질종양(GIST), 급성골수성백혈병(AML), 선단흑색종(acral melanoma), 비만세포증(mastocytosis) 등의
암종 및 희귀질환에서 활성 변이가 관찰된다.
▲질환 별 c-KIT 변이 발생 빈도 (노벨티노빌리티
제공) 박
대표는 “노바티스에서 개발한 항암제 ‘글리벡(성분명 이마티닙)’의
내성 발생 및 치료 저항성의 주요 요인이 바로 c-KIT 변이”라며 “c-KIT 변이는 exon 9, 11, 13, 14, 17 등에서 발생한다. 일부 c-KIT 변이를 커버할 수 있는 약물이 존재하긴 하지만 아직
미충족 수요가 존재한다”고 말했다. 노벨티노빌리티는 c-KIT에 특이적으로 결합하는 항체에 약물을 접한한
ADC(Antibody-Drug Conjugate) 형태의 치료제를 개발하고 있다. 회사
측은 “우리가 개발한 항체의 경우, 모든 변이를 효과적으로 저해할 수 있는 형태로 c-KIT 수용체 자체를 제거하는 것이 가능하다”고 설명했다. 이들은
글리벡 저항성 만성골수성백혈병 세포주와 GIST 세포주, 비만세포증
세포주를 이용해서 페이로드(payload) 대비 자사의 ADC의
약물반응성이 최소 100배에서 최대 1000만배까지 향상되는
실험 결과를 얻었다고 밝혔다. 박
대표는 “노바티스도 c-KIT 항체 기반의 ADC 항암제를
개발했지만 면역과민반응으로 인해 임상1상에서 실패했다. 우리는
보유한 항체 노하우를 활용해 ADCC를 최소화하는 형태로 항체 Fc부분을
설계해 이런 위험을 줄일 수 있을 것으로 기대한다”고 말했다. 박상규
대표는 “신약 개발의 꿈을 실현하기 위해 창업을 결심했고 그에 맞춰 바이오시밀러 개발 보다는 ‘퍼스트-인-클래스’ 약물 개발에 초점을 맞추고 있다”면서 “여러가지 새로운 기술들이 속속 등장하고 있지만 가장 자신있는
항체를 이용해 현장의 언멧니즈를 충족시킬 수 있는 신약을 개발하겠다”고 의지를 표했다. 조정민 기자 joungmin.cho@bios.co.kr <저작권자 © 바이오스펙테이터 무단전재 및 재배포 금지> 보도자료 및 기사제보 press@bios.co.kr
|
|
| Prev | [수상] 노벨티노빌리티 NN3201, KSBMB서 항암효과 발표…우수 포스터상 수상 |
| Next | |

 ddd
ddd